Tabla periódica de los elementos
Seguramente ya habrás visto alguna vez una tabla como la siguiente, se llama tabla periódica. Esta tabla es un recurso de los más utilizados y valiosos para los científicos, especialmente para los químicos.
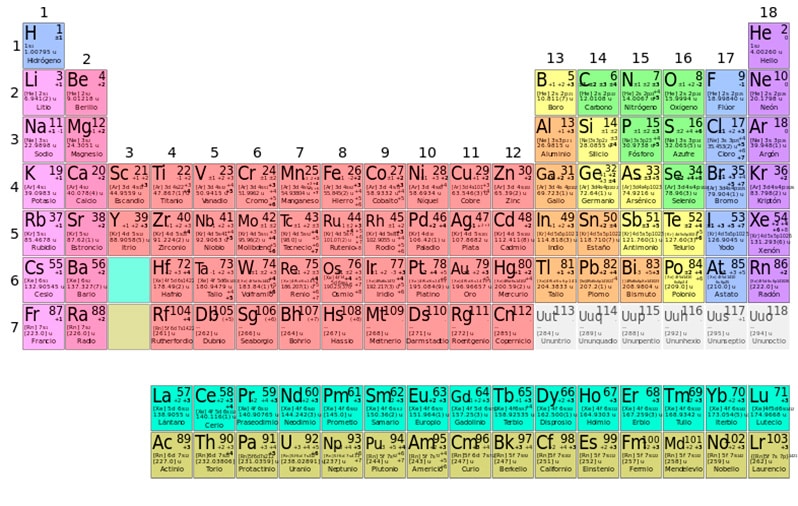
Los científicos usan mucho esta tabla porque ordena los elementos químicos de nuestro planeta de forma útil. Por ello, es muy importante que conozcas qué es la tabla periódica, cuál es la historia de la tabla periódica, cómo está organizada la tabla periódica, cuáles son los grupos de la tabla periódica, y cuáles son esos elementos que hay en la tabla periódica.
¡Y en este artículo te lo explicamos todo esto de forma muy sencilla!
Qué es la tabla periódica
Recuerda que los elementos son sustancias puras compuestas de un sólo átomo (por ejemplo, el carbono, aluminio, neón, etc.). En la tabla periódica los elementos aparecen organizados de izquierda a derecha y de arriba a abajo en orden creciente según su número atómico. Esta forma de organizarlos coincide con el aumento de la masa atómica.
Cada una de las 7 filas de elementos se denominan períodos. El número de período de un elemento se refiere al nivel más alto de energía que ocupa un electrón en ese elemento (en su estado no excitado, es decir, sin que se le haya transferido energía al átomo).
A medida que vamos recorriendo la tabla periódica vemos que el período aumenta, esto se debe a que cada vez que el nivel de energía del átomo se incrementa, también aumenta el número de subniveles de energía por nivel de energía.
Científicos, profesores, estudiantes y cualquier otra persona que esté vinculada con la tabla periódica puede obtener información sobre cada uno de los elementos por separado. Por ejemplo, un científico puede utilizar la masa atómica del aluminio para determinar cuántos átomos de aluminio hay en una varilla de aluminio que pesa 30 gramos.
También se puede obtener información de la tabla periódica a partir de la manera en la que está organizada. A partir de la posición que ocupe un elemento en la tabla periódica, es posible establecer su configuración electrónica.
Los elementos ubicados en la misma columna de la tabla periódica (llamadas grupos o familias) tienen configuraciones electrónicas de valencia idénticas.
Los elementos de cada grupo cuentan con igual número de electrones disponibles para compartir. Algunos de estos electrones están fuertemente unidos al átomo. Mientras que otros se encuentran en una unión menos estrecha, por lo que pueden desagregarse con facilidad y juntarse con otros átomos. Estos electrones externos, sueltos, son electrones de valencia.
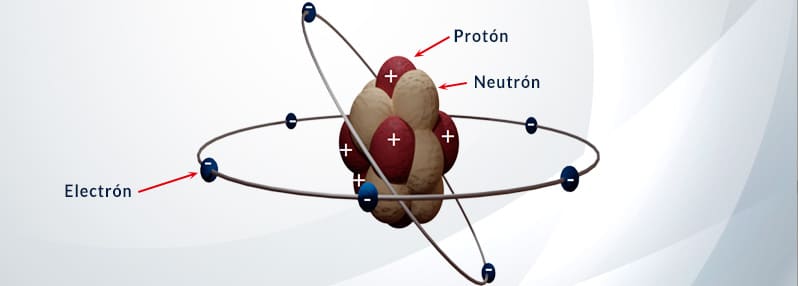
El átomo y sus partículas subatómicas
Los elementos que son del mismo grupo tienen configuraciones de valencia idénticas, por lo que se comportan químicamente de forma similar. Por ejemplo, todos los elementos de la columna 1 son metales alcalinos.
La tabla periódica sintetiza una gran cantidad de información y su gran valor consiste en que gracias a la manera en la que ha sido ordenada se puede obtener una buena cantidad de datos significativos sobre un elemento químico.
Historia de la tabla periódica
Los investigadores generalmente han buscado maneras de clasificar los elementos para develar las semejanzas entre sus propiedades. En la actualidad la tabla periódica ordena los elementos de forma creciente con base en el número atómico (el número de protones en el núcleo del átomo).
Al principio esto no era así, los científicos trataron de organizar los elementos químicos a partir de las masas atómicas relativas. La razón por la que utilizaron este tipo de clasificación fue porque aún no se había formulado la idea de que los átomos están formados por protones, neutrones y electrones (partículas subatómicas más pequeñas).
Aunque la verdad es que la tabla periódica organizada con base en las masas atómicas estaba bien planteada. De hecho, se utilizaba para predecir las características de elementos no descubiertos.
Los inicios de la tabla periódica se remontan al año 1789 cuando Antoine Lavoisier clasificó los elementos según sus propiedades en no metales, metales, tierras y gases. Durante los siguientes años, los investigadores continuaron buscando nuevas formas de agrupar los elementos químicos.
En el año 1817, Johann Dobereiner logró darse cuenta que el peso atómico del estroncio se encontraba en el punto medio de los pesos del calcio y el bario, elementos con propiedades químicas bastante parecidas. En 1829 este científico descubre la tríada de halógenos conformada por bromo, cloro y yodo y la tríada de metales alcalinos de sodio, litio y potasio, a partir de los cuales concluye que la naturaleza tenía tríadas en las que las propiedades del elemento del medio eran un promedio de los otros dos miembros cuando se ordenó por el peso atómico.
En Alemania, en el año 1860 sale a la luz una lista más precisa de la masa atómica de los elementos, este hecho significó un pasó muy importante en la creación y posterior desarrollo de la tabla periódica.
El químico alemán Lothar Meyer y el ruso Dmitri Mendeleev, los dos formados en la Universidad de Heidelberg, se disputan la autoría de la tabla periódica. Ambos químicos produjeron resultados notablemente similares al mismo tiempo trabajando independientemente uno del otro.

El libro de texto de Meyer de 1864 contenía un modelo bastante simplificado de una tabla periódica utilizada para clasificar los elementos. Esta matriz contenía solo 28 elementos, organizados por su valencia (con cuántos otros átomos se pueden combinar). Estos elementos eran casi en su totalidad elementos del grupo principal. En esta obra este químico demostró cambios periódicos de valencia en función del peso atómico.
En 1868 Meyer construyó una tabla en la que incorporó los metales de transición. Esta versión de la tabla periódica enumeró los elementos en orden de peso atómico, con elementos con la misma valencia dispuestos en líneas verticales, era muy similar a la tabla de Mendeleev.
Desafortunadamente para Meyer la tabla de Mendeleev estuvo disponible para la comunidad científica, un poco antes que la de Meyer, a través de una publicación en el año 1869. El trabajo de Meyer fue publicado en 1870, un año después de que se publicara la tabla periódica de Mendeleev.
Como hemos visto, Mendeleev no fue el único que logró encontrar el orden dentro de los elementos, pero su aporte fue tan importante que se convirtió en la base de la tabla periódica moderna.
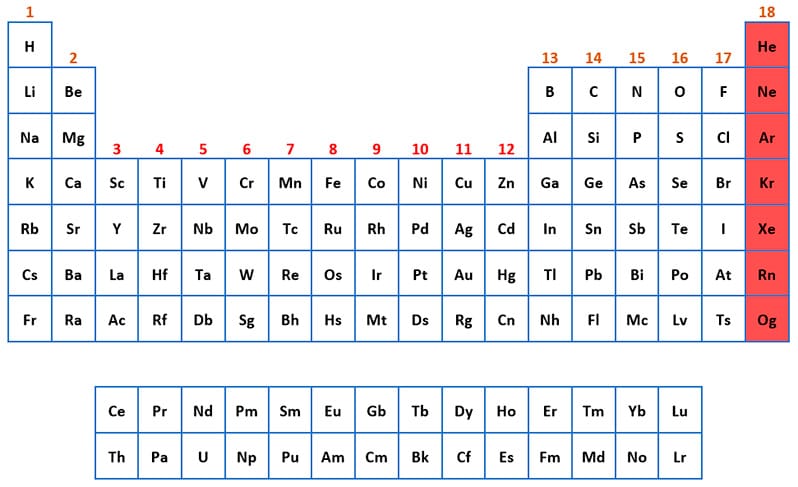
Cómo está organizada la tabla periódica
Conocer cómo se organiza la tabla periódica te permitirá predecir las propiedades de los elementos en función de dónde están ubicados en la tabla. Así es como se organizan por número en filas y columnas, como en una cuadrícula.
Veamos de qué se trata esta organización:
El número del elemento
Los elementos de la tabla periódica están enumerados en orden ascendente por el número atómico correspondiente a cada elemento.
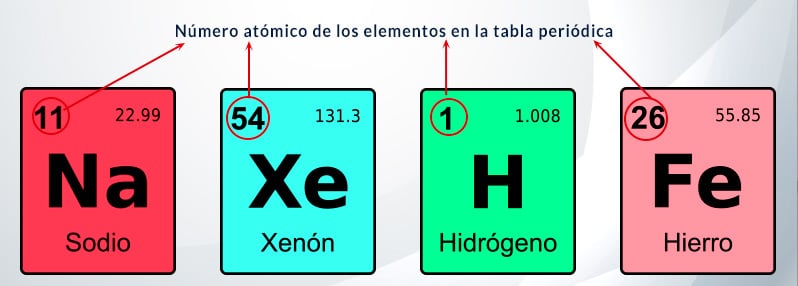
Observa el hidrógeno, por ejemplo, que es el elemento con el número 1 y el primer elemento de la tabla, cada átomo de hidrógeno tiene un protón.
El último elemento de la tabla periódica actual es el oganesón cuyo número atómico es 118, es decir, cada átomo de este elemento tiene 118 protones y fue incorporado en la tabla periódica en el año 2015.
Fila (horizontal)
Cada una de las filas de la tabla periódica se llama período, y en la tabla hay 7 períodos. Estas filas o períodos se leen de izquierda a derecha, y a medida que avanzamos de izquierda a derecha por un período los elementos pasan de tener características metálicas a características no metálicas.
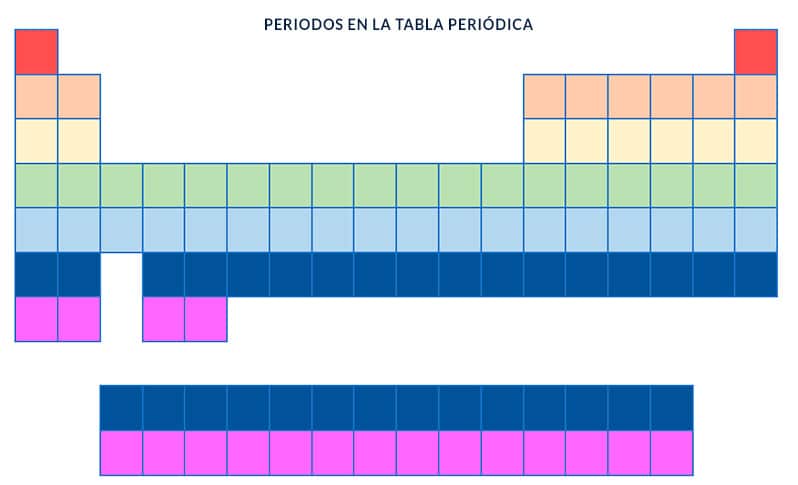
Todos los elementos de un período (de una fila) tienen igual cantidad de orbitales atómicos.
Por ello, todos los elementos en el mismo período tienen el mismo nivel de energía en el estado fundamental de los electrones.
Columna (vertical)
Cada una de las columnas de la tabla se llama grupo. La tabla periódica tiene 18 grupos de elementos.
En la tabla periódica los elementos de un mismo grupo tienen la misma cantidad de electrones de valencia y los elementos de un mismo período tienen la misma cantidad de orbitales atómicos ocupados.
La excepción del Hidrógeno y el Helio
Existe una excepción en la forma en que están organizados los elementos de la tabla periódica, y esta excepción es el helio (He) y el hidrógeno. El helio debería estar en el grupo 2 pues, al igual que el hidrógeno, tiene dos electrones en su orbital exterior.
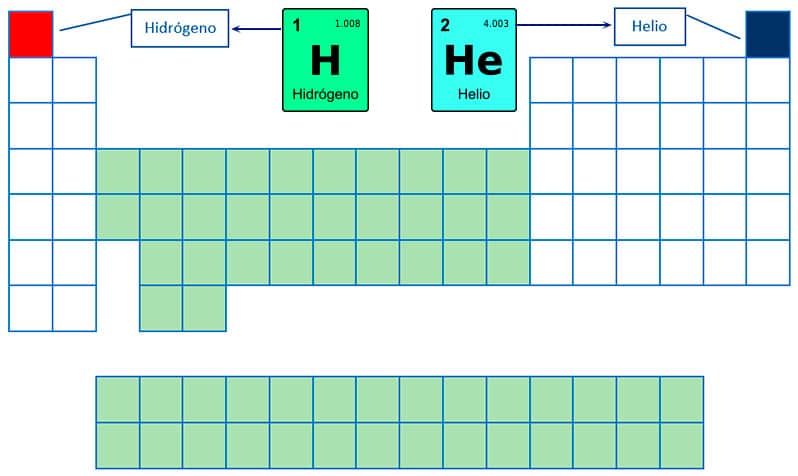
Sin embargo, se coloca en el grupo 18 de los gases nobles (que tienen 18 electrones de valencia) porque presenta las propiedades de un gas noble. Es decir, el helio tiene el nivel de energía completo, lo que significa que su capa de valencia está llena, así como la de los gases nobles.
El hidrógeno, por su parte, no tiene un neutrón cuando está en su forma neutra. Solo tiene un electrón y un protón por lo que no pertenece a ninguno de los grupos, y ocupa el primer lugar de la tabla periódica, en el mismo período del helio.
Grupos de la tabla periódica
La tabla periódica está formada por 18 grupos de elementos que se encuentran organizados de forma vertical.
- El grupo 1 es el grupo de metales alcalinos (sin incluir el hidrógeno).
- El grupo 2 es el grupo de metales alcalinotérreos.
- Los grupos 3 al 12 son los grupos de metales de transición y de transición interna.
- El grupo 13 es el grupo de boro.
- El grupo 14 es el del carbono.
- El grupo 15 es el grupo del nitrógeno.
- El grupo 16 corresponde a los calcógenos.
- El grupo 17 es de los halógenos.
- El grupo 18 es el de los gases nobles.
Los elementos de un mismo grupo poseen la misma cantidad de electrones en su orbital exterior (capa electrónica más externa), es decir, poseen la misma cantidad disponible de electrones para compartir.
La idea fundamental detrás de esto es que, aunque algunos electrones están estrechamente unidos al átomo y se quedan “pegados” a él, existen otros electrones que están más “sueltos” o ligados al átomo de forma un poco más débil. Estos electrones sueltos pueden separarse fácilmente y compartirse con otros átomos.
Los electrones sueltos son llamados electrones de valencia. Y los electrones de valencia son los únicos electrones que intervienen en los enlaces químicos, de ahí su importancia.
Veamos cuáles son los elementos que pertenecen a cada uno de estos grupos:
Cuáles son los elementos de la tabla periódica
A continuación te presentamos los elementos de la tabla periódica por grupos:
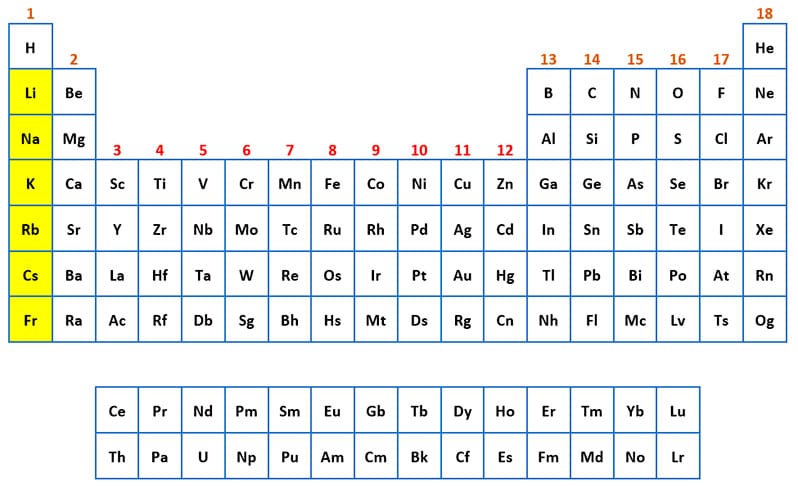
Grupo 1: Metales alcalinos
Los metales alcalinos son los metales que forman una base fuerte, llamada álcalis o solución alcalina, al reaccionar con el agua. Estos elementos son altamente reactivos.
Grupo de los Metales Alcalinos
Los elementos de este grupo son:
- Litio (Li)
- Sodio (Na)
- Potasio (K)
- Rubidio (Rb)
- Cesio (Cs)
- Francio (Fr)
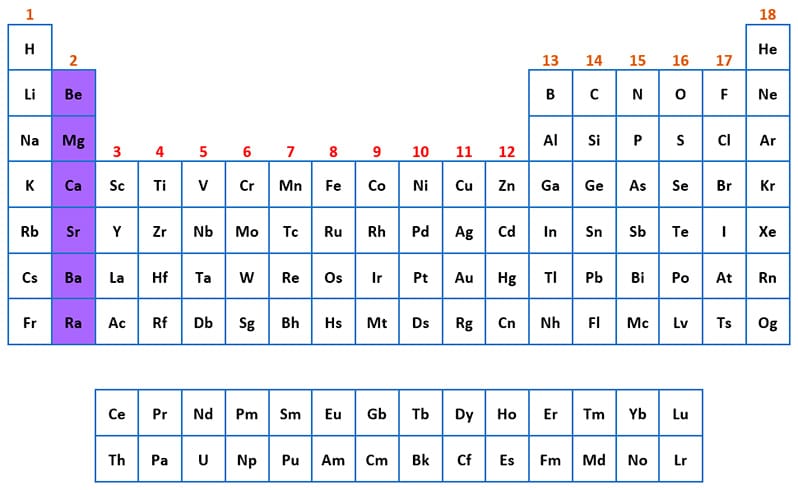
Grupo 2: Metales alcalinotérreos
Estos metales cumplen con dos características:
- Al reaccionar con el agua, forman hidróxidos que son de naturaleza alcalina.
- Sus minerales de óxido se encuentran principalmente en la corteza terrestre y son estables al calor.
Grupo de los metales alcalinotérreos
Los elementos de este grupo son:
- Berilio (Be)
- Magnesio (Mg)
- Calcio (Ca)
- Estroncio (Sr)
- Bario (Ba)
- Radio (Ra)
Debemos decir que el berilio (Be) es el único metal de este grupo que no forma una solución alcalina cuando reacciona con el agua. El hidróxido de berilio no muestra comportamiento alcalino sino anfótero, es decir, actúa como ácido o como base según la sustancia con la que reaccione. Por tanto, el berilio es el único elemento del grupo 2 que no se considera un metal alcalinotérreo.
Grupos 3 al 11: Metales de transición y de transición interna
Algunas características de los metales de transición son las siguientes:
- Por lo general son buenos conductores de electricidad y de calor.
- Son maleables y dúctiles.
- Casi siempre sus compuestos tienen colores brillantes en solución.
- Son sólidos duros, poseen punto de fusión y punto de ebullición elevados.
- Generalmente sus compuestos son paramagnéticos.

Grupo de los metales de transición y de transición interna
Los metales de transición interna se llaman así por dos razones:
- Sus propiedades muestran la transición de la naturaleza electropositiva a la naturaleza electronegativa.
- Se encuentran en la sección interna de la tabla periódica, y son una extensión de los elementos del grupo 3.
Los elementos de este grupo son:
Metales de transición y de transición interna | ||||
|---|---|---|---|---|
| Escandio (Sc) | Ytrio (Y) | Lantano (La) | Actinio (Ac) | Titanio (Ti) |
| Circonio (Zr) | Hafnio (Hf) | Rutherfordio (Rf) | Vanadio (V) | Niobio (Nb) |
| Tantalio (Ta) | Dubnio (Db) | Cromo (Cr) | Molibdeno (Mo) | Tungsteco (W) |
| Seaborgio (Sg) | Manganeso (Mn) | Tecnecio (Tc) | Renio (Re) | Bohrio (Bh) |
| Hierro (Fe) | Rutenio (Ru) | Osmio (Os) | Hasio (Hs) | Cobalto (Co) |
| Rodio (Rh) | Iridio (Ir) | Meitnerio (Mt) | Níquel (Ni) | Paladio (Pd) |
| Platino (Pt) | Darmstatio (Ds) | Cobre (Cu) | Plata (Ag) | Oro (Au) |
| Roentgenio (Rg) | Cinc (Zn) | Cadmio (Cd) | Mercurio (Hg) | Copérnico (Cn) |
| Cerio (Ce) | Praseodimio (Pr) | Neodimio (Nd) | Prometio (Pm) | Samario (Sm) |
| Europio (Eu) | Gadolinio (Gd) | Terbio (Tb) | Disprosio (Dy) | Holmio (Ho) |
| Erbio (Er) | Tulio (Tm) | Iterbio (Yb) | Lutecio (Lu) | Torio (Th) |
| Protactinio (Pa) | Uranio (U) | Neptunio (Np) | Americio (Am) | Curio (Cm) |
| Berkelio (Bk) | Californio (Cf) | Einstenio (Es) | Fermio (Fm) | Mendelevio (Md) |
| Nobelio (No) | Laurencio (Lr) | |||
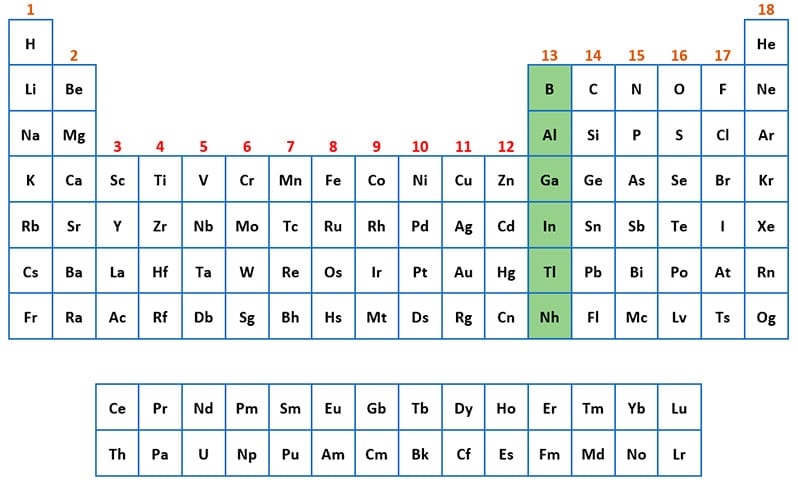
Grupo 13: del boro
Grupo del Boro
Los elementos del grupo del boro son:
- Boro (B)
- Aluminio (Al)
- Galio (Ga)
- Indio (In)
- Talio (Tl)
- Nihonio (Nh)
Grupo 14: del carbono
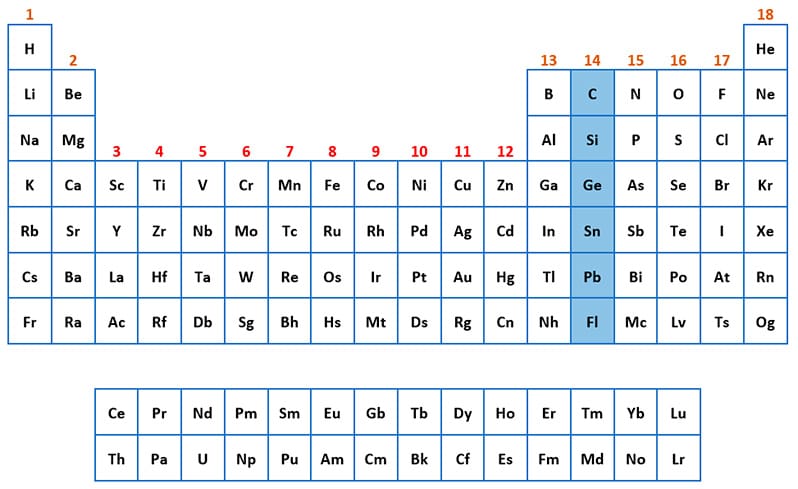
Grupo del Carbono
En este grupo se encuentran los siguientes elementos:
- Carbono (C)
- Silicio (Si)
- Germanio (Ge)
- Estaño (Sn)
- Plomo (Pb)
- Flerovio (Fl)
Grupo 15: del nitrógeno
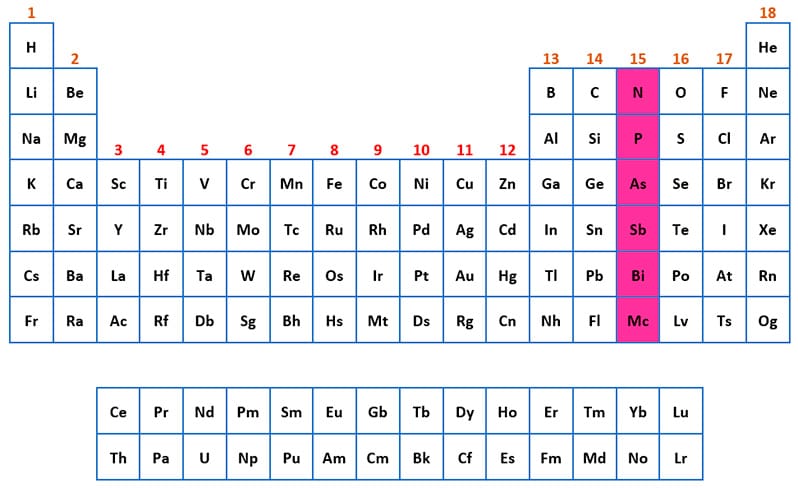
Grupo del Nitrógeno
En este grupo están:
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Moscovio (Mc)
Grupo 16: del oxígeno
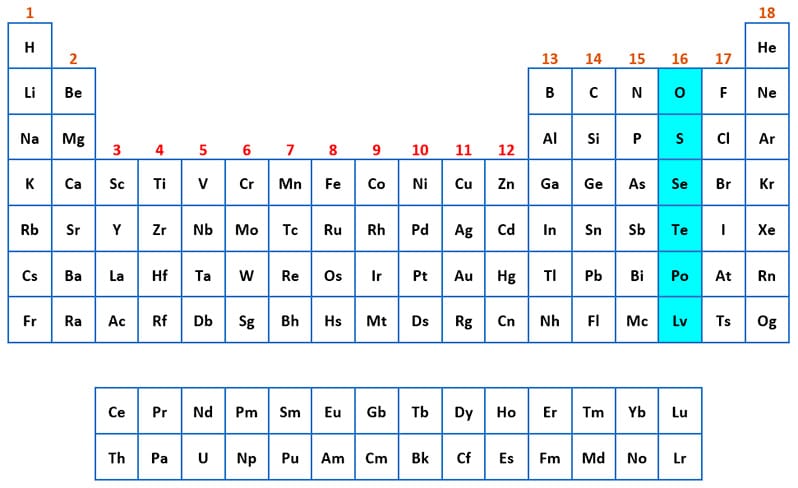
Grupo del Oxígeno
Los elementos que están en este grupo son:
- Oxígeno (O)
- Azufre (S)
- Selenio (Se)
- Telurio (Te)
- Polonio (Po)
- Livermorio (Lv)
Grupo 17: halógenos
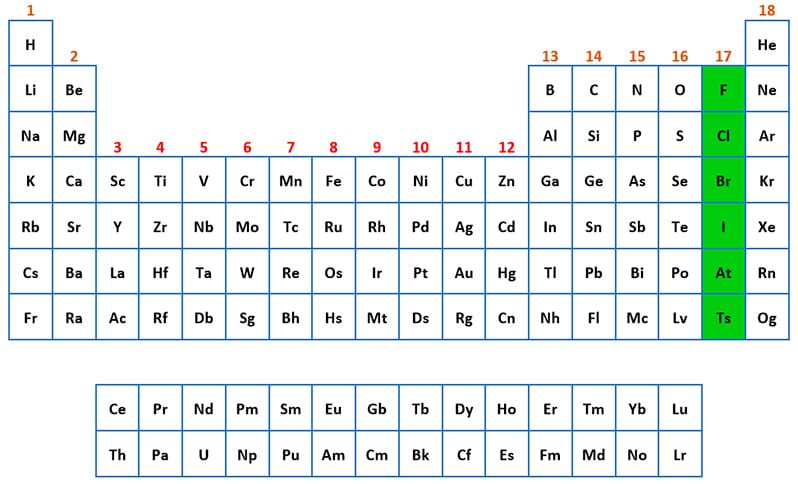
Grupo de los Halógenos
En este grupo se encuentran los siguientes elementos:
- Fluorita (F)
- Cloro (Cl)
- Bromo (Br)
- Yodo (I)
- Astato (At)
- Teneso (Ts)
Grupo 18: Grupo de gases nobles
Grupo de los Gases Nobles
El grupo 18 es el último grupo de la tabla periódica, y está formado por estos elementos:
- Helio (He)
- Neón (No)
- Argón (Ar)
- Kriptón (Kr)
- Xenón (Xe)
- Radón (Rn)
- Oganesón (Og)
Antes de concluir, te dejamos unos cuantos recursos más para que practiques lo aprendido.
Selecciona un juego 👇 👇 👇

Definición de la tabla periódica

Historia de la tabla periódica

Casillas de la tabla periódica

Períodos y grupos en la tabla periódica

Grupos de la tabla periódica

Elementos de la tabla periódica

Definición de la tabla periódica

Historia de la tabla periódica

Casillas de la tabla periódica

Períodos y grupos en la tabla periódica

Grupos de la tabla periódica

Elementos de la tabla periódica
También te pueden interesar estos temas de Ciencias Naturales
Recursos de ciencias naturales
- FÍSICA Y QUÍMICA
- 1.- El mol
- 2.- Estados de la materia
- 3.- Estructura atómica
- 4.- Ley de Newton
- 5.- Máquinas simples y máquinas compuestas
- 6.- Metodología científica
- 7.- Tabla periódica de los elementos