Estructura atómica
Conocer la estructura atómica (estructura de los átomos) ha dado a los científicos una mejor comprensión de su comportamiento, propiedades físicas, enlaces y reacciones químicas. Lo que ha permitido el avance de la ciencia gracias a innumerables inventos y descubrimientos en distintas disciplinas científicas.
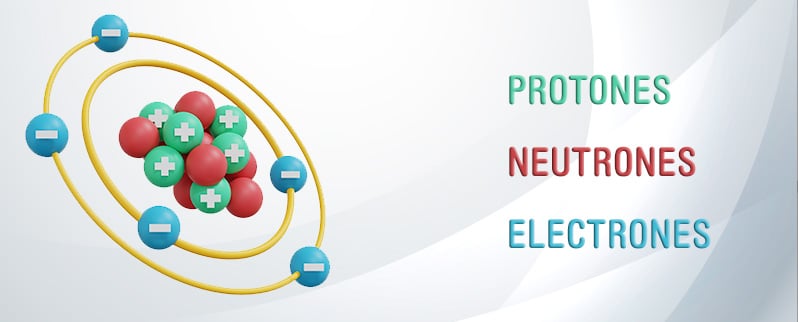
Para que conozcas más acerca de este importante tema, en este artículo te explicamos qué es la estructura atómica, la estructura atómica de la materia, modelos atómicos qué son y un resumen de los modelos atómicos.
Qué es la estructura atómica
La estructura atómica es la forma en que están dispuestas las partículas subatómicas dentro del átomo.

Hoy en día sabemos que la estructura del átomo se compone de neutrones, protones y electrones. Los dos primeros se encuentran en el núcleo del átomo, mientras que los electrones se encuentran orbitando alrededor de este núcleo.
Pero no siempre supimos esto, de hecho, el nombre átomo quiere decir “indivisible”, tanto en latín como en griego, y eso es porque en la Antigüedad, incluso en los primeros modelos atómicos como el de Dalton, no se tenía conocimiento de la estructura atómica, que no es otra cosa que la estructura propia del átomo.
Un poco de historia de la estructura atómica
La historia de la estructura atómica se remonta al año 1897. En ese año J.J. Thomson descubrió que los átomos contenían partículas aún más pequeñas llamadas electrones. Pero se creía que los átomos eran estructuras sólidas que tenían estas partículas, los electrones, incrustadas en ellos, así como las chispas de chocolate en las galletas.

En el año 1911 Rutherford lo cambió todo en la comunidad científica cuando publicó «La dispersión de las partículas alfa y beta por la materia y la estructura del átomo». Este científico logró explicar que la masa de un átomo no podía estar distribuida de manera uniforme, como se había pensado hasta entonces, sino que estaba más bien concentrada en el centro.
Rutherford fue la primera persona que probó que el átomo tenía una estructura “extraña” con casi toda su masa concentrada en un pequeñísimo y denso centro, que él llamó núcleo, y que la mayor parte de un átomo es un espacio vacío. Fuer Rutherford quien descubrió el protón, que está cargado positivamente.

Para completar la estructura atómica que conocemos hoy, en el año 1932 James Chadwick descubrió una partícula más en el núcleo del átomo, el neutrón. De hecho, Chadwick ganó el premio Nobel de Física en el año 1935 por este descubrimiento.

Estructura atómica de la materia
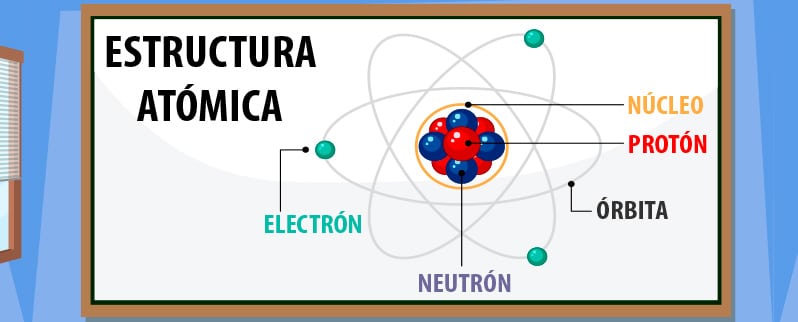
Como dijimos antes, la estructura de la materia se compone de átomos, y los átomos a su vez tienen tres tipos de partículas subatómicas llamadas protones, neutrones y electrones. En el núcleo, que es la parte central del átomo, se encuentran los protones y los neutrones. Esa es la parte del átomo con mayor masa con una densidad de 1013 a 1014 gramos por centímetro (g/cm).
Por su parte, la corona electrónica es la parte exterior del átomo, se encuentra alrededor del centro. En ella están los electrones orbitando, y su diámetro es mayor al diámetro del núcleo, aunque es el núcleo el que posee mayor masa.
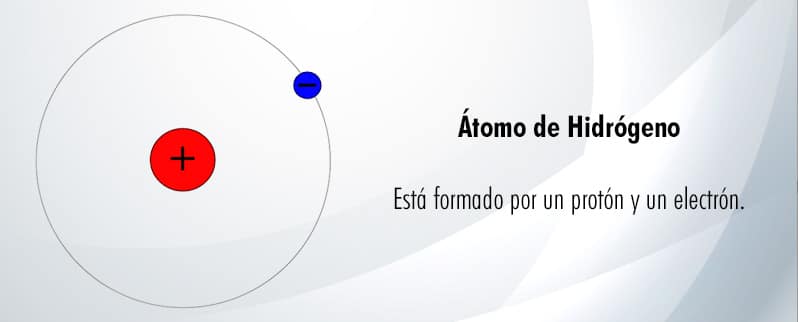
Aunque los átomos pueden parecer repletos con todas sus partículas subatómicas, en realidad son mayormente espacio vacío. Observa como ejemplo el átomo de hidrógeno, el elemento más ligero que existe. Este es el átomo más simple pues en su estructura solo contiene un protón y un electrón orbitando alrededor de él.
Veamos algunas características importantes de las subpartículas atómicas:
Qué son los protones
Se encuentran agrupados densamente en el núcleo, es decir, en el centro del átomo. Son muy pequeños, su masa es de 1,67 x 10-27 Kg y su diámetro es de 1,2 10-13 cm.
Al conocer el número de protones en un átomo podemos saber en qué lugar de la tabla periódica se encuentra ese elemento. Esto es así porque el número atómico (Z) de cada elemento es el número de protones en su núcleo, y según ese número es que están ordenados los elementos en la tabla periódica, empezando por el hidrógeno que posee uno protón, y siguiendo con el helio que posee dos protones en su núcleo.
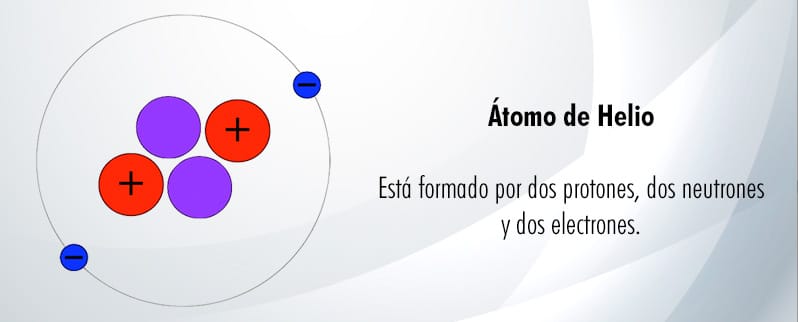
Además, la cantidad de protones que posee un átomo nos ayuda a saber cuáles son las propiedades químicas que posee.
Qué son los neutrones
Los protones se caracterizan por no tener carga eléctrica. Además, su masa es mínimamente mayor que la de los protones, pues la masa de un neutrón es 1,67493 × 10−27 kg. Aunque sí son mucho mayores en masa que los electrones, ya que tienen casi 1839 veces la masa del electrón.
Los neutrones y los protones son llamados también nucleones pues están unidos en el núcleo del átomo, del cual representan el 99,9% de su masa.
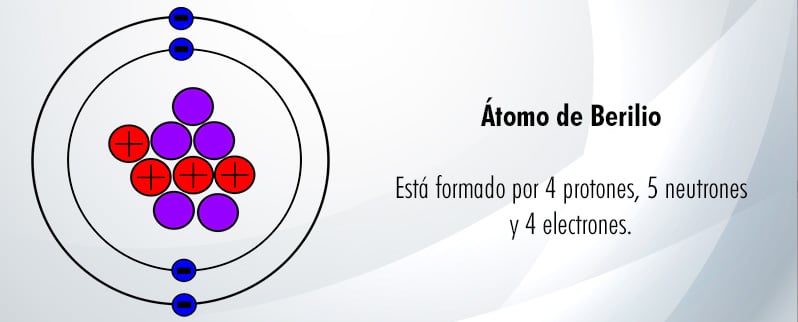
Qué son los electrones
La masa del electrón es 9,11 x 10-31 kg, mucho menor que la masa del protón y del neutrón, y su diámetro es de 2,8 x 10-13 cm.
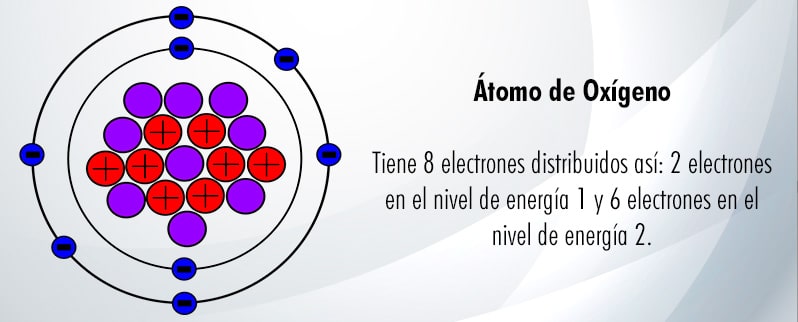
A diferencia de protones y neutrones, los electrones no están en el núcleo del átomo, sino que orbitan alrededor de él, en las llamadas capas o niveles de energía. Los niveles de energía en los que orbitan los electrones aumentan a medida que se alejan del núcleo, y son los electrones que se encuentran en la capa más externa del átomo los que toman parte en las uniones o enlaces químicos.
Por ejemplo, el átomo de oxígeno tiene 8 electrones distribuidos de la siguiente manera: 2 electrones en el nivel de energía 1 y 6 electrones en el nivel de energía 2.
Como se necesitan 8 electrones para que la capa 2 esté completa y estable, el oxígeno toma 2 electrones cuando realiza sus enlaces químicos con otros elementos.
Observa cómo sucede esto con la molécula de agua, compuesta por un átomo de oxígeno y dos átomos de hidrógeno:
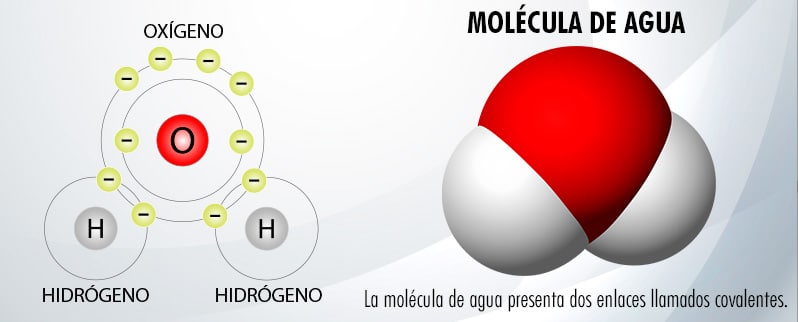
Por ello, el número de electrones que hay en un átomo determina sus propiedades químicas y la forma cómo reacciona.
Qué son los modelos atómicos
A través del tiempo han sido elaborados con base en las ideas que pensadores, filósofos o científicos han asumido como ciertas sobre la composición de la materia.
Los modelos atómicos han sido una gran ayuda para el entendimiento de la materia, su relevancia radica en el hecho de que cada uno ha servido de apoyo o cimiento para el surgimiento del siguiente modelo, hasta alcanzar la comprensión que tenemos hoy.
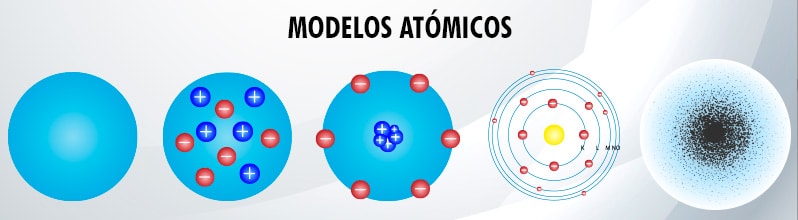
Resumen modelos atómicos (400 a.C.)
Los filósofos de la Antigua Grecia fueron los primeros en dedicar tiempo a pensar y deducir la forma en la que está compuesta la materia. Demócrito inició la búsqueda de una descripción de la materia, por esa razón el primer modelo de la historia lleva su nombre.
Este filósofo se interesó por saber si la materia podía ser dividida una y otra vez en porciones cada vez más pequeñas, hasta llegar a un punto en el que no se pudiera dividir más. Esta unidad fundamental o básica era lo que Demócrito llamaba átomo.
Demócrito fue la primera persona en utilizar el término átomo esta palabra proviene del griego atémnein y significa “indivisible”.
Desde los tiempos de la Grecia antigua se estableció que toda la materia estaba formada por átomos, que son pedazos de materia demasiado pequeños para ser vistos.
Modelo atómico de Dalton (1803-1808)
John Dalton fue el primero en darle bases científicas a la teoría de Demócrito, este químico explicaba en sus Postulados Atómicos, que todo estaba compuesto por átomos indivisibles e indestructibles.

Las 4 características fundamentales del modelo atómico de John Dalton son las siguientes:
- Toda la materia está formada por partículas muy pequeñas llamadas átomos.
- Los átomos son indestructibles e inmutables.
- Los elementos se caracterizan por el peso de sus átomos.
- La reacción de los elementos ocurre porque sus átomos se combinan para formar nuevos compuestos
Dalton entre otras cosas introdujo la idea del peso atómico relativo, su propuesta consistía en establecer el peso de cada elemento con respecto al peso del hidrogeno. También, explicó que los átomos de un mismo elemento químico contaban con igual masa, las mismas propiedades, además de ser idénticos entre sí.
No todo fueron aciertos para Dalton, por ejemplo, su suposición de que los elementos en estado gaseoso siempre estaban compuestos por un solo átomo resultó ser falsa.
Modelo atómico de Thomson (1897)
J.J Thomson fue un físico al que se le reconoce haber sido quien descubrió el electrón. Este científico propone su modelo atómico antes del descubrimiento de los protones y neutrones, razón por la que consideró que cada átomo estaba constituido por una esfera llena de carga positiva (el componente dentro de la esfera se asemejaba a la mermelada de un pudín) y los corpúsculos (luego serían llamados electrones), eran las partículas cargadas negativamente incrustadas en este fluido, como las pasas en el pudín. Esta comparación hizo que a este modelo se le conociera como el Modelo del Pudín de Pasas.

Este modelo explicaba que la carga positiva se encontraba distribuida uniformemente por todo el átomo, lo que resultó ser incorrecto. Esta afirmación fue refutada acertadamente por el modelo de Rutherford donde se definió el núcleo atómico.
Modelo atómico de Rutherford (1910)
Ernest Rutherford tenía dudas acerca de la veracidad del modelo del átomo propuesto por Thomson, por lo que diseño su famoso experimento Papel de Oro.
De manera resumida el experimento consistía en disparar partículas cargadas positivamente a una lámina de oro, para luego medir la desviación a medida que salían las partículas por el otro lado. El resultado fue que la gran mayoría de las partículas no se desviaron ni siquiera un poco. Muy pocas veces una partícula se desviaba todo el camino de vuelta. Por esta razón Rutherford sabía que había un centro positivo en la lámina de oro.
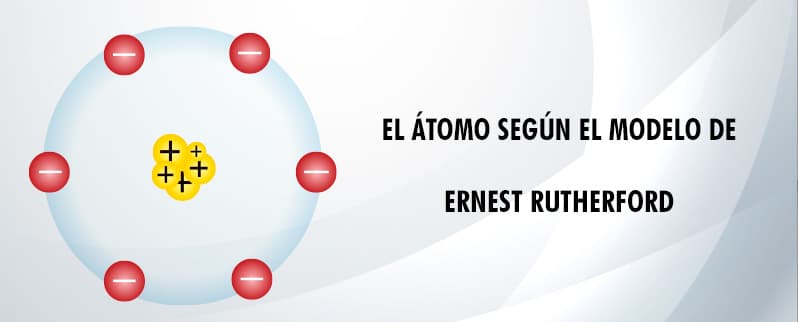
Gracias a este experimento Rutherford concluyó que:
- El núcleo del átomo es una masa densa de partículas cargadas positivamente.
- Los electrones orbitan alrededor del núcleo.
- Un interrogante que se planteó este científico fue: ¿por qué las partículas cargadas negativamente no son atraídas por las que están cargadas positivamente?
- Rutherford dijo que el átomo se comportaba como un mini sistema solar, esto debido a que los electrones se mueven alrededor del núcleo en una amplia órbita.
Al modelo atómico de Rutherford se le conoce con el nombre de modelo planetario.
Modelo atómico de Bohr (1913)
Para Niels Bohr el modelo atómico de Rutherford era correcto, pero pensaba que tenía algunos defectos que debían ser corregidos. Este científico utilizó sus conocimientos sobre física cuántica para perfeccionar el modelo planetario.

El modelo atómico de Bohr se rige por los siguientes postulados.
- Los electrones giran alrededor del núcleo en una trayectoria circular fija llamada órbitas.
- Cada órbita circular tiene cierta cantidad de energía fija. Las orbitas circulares se denominan capas orbitales. Los electrones no irradian energía mientras estén girando alrededor del núcleo en las capas orbitales fijas.
- Los diferentes niveles de energía se indican con números enteros como n=1 o n = 2 o n = 3 y así sucesivamente. Estos se llaman números cuánticos. El rango de números cuánticos puede variar y comenzar desde el nivel de energía más bajo (lado del núcleo n=1) hasta el nivel de energía más alto.
- El cambio de energía ocurre cuando los electrones saltan de un nivel de energía a otro. En un átomo, los electrones se mueven de menor a mayor nivel de energía adquiriendo la energía requerida. Sin embargo, cuando un electrón pierde energía, pasa de un nivel de energía más alto a uno más bajo.
Modelo atómico de Schrödinger (1926)
Erwin Schrödinger fue un físico de ideas innovadoras que se basó en el principio de incertidumbre de Heisenberg para plantear el modelo atómico utilizamos hoy en día.

El modelo atómico de Schrödinger se basa en los siguientes principios.
- Un electrón no viaja en una órbita exacta.
- Se puede estudiar probabilísticamente la posición de un electrón o su cantidad de movimiento, pero no ambas cosas a la vez.
- Podemos predecir dónde estará probablemente un electrón.
- El tipo de órbita de probabilidad depende del nivel de energía descrito por Bohr.
Antes de concluir, te dejamos unos cuantos recursos más para que practiques lo aprendido.
Selecciona un juego 👇 👇 👇

Definiciones sobre el átomo

Partículas subatómicas

Partes de un átomo

Estructura del átomo

Modelos atómicos 1

Modelos atómicos 2
También te pueden interesar estos temas de Ciencias Naturales

Definiciones sobre el átomo

Partículas subatómicas

Partes de un átomo

Estructura del átomo

Modelos atómicos 1

Modelos atómicos 2
También te pueden interesar estos temas de Ciencias Naturales