Estados de la materia
- 1.- Qué es la materia y cuáles son sus propiedades
- 2.- Cómo está compuesta la materia
- 3.- Las propiedades de la materia
- 4.- Materia y materiales
- 5.- ¿Qué es la materia?
- 6.- ¿Qué es un cuerpo?
- 7.- ¿Qué son los materiales?
- 8.- Diferencia entre materia y materiales
- 9.- Tipos de materia y características
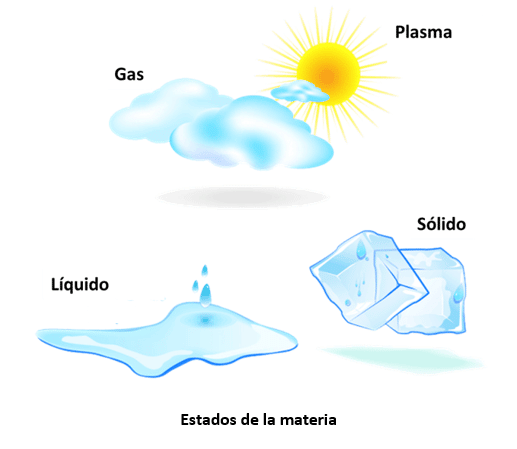
- 10.- ¿Qué son los estados de la materia?
- 11.- Cuáles son los estados fundamentales de la materia
- 12.- Cambios de estados de la materia
- 13.- Por qué ocurren los cambios de estado de la materia
- 14.- Clasificación de los cambios de estado de la materia
- 15.- Experimentos sencillos para cambios de estado de la materia
- 16.- Nuevos estados de la materia
De qué están compuestas todas las cosas que nos rodean, e incluso los objetos que vemos en el espacio, ha sido una pregunta que se ha hecho la humanidad desde hace muchos años. Los científicos le han dado el nombre de materia a eso que compone todas las cosas en la Tierra y en el espacio. En este artículo conocerás acerca de los estados de la materia y mucho más sobre la materia en sí misma.
Qué es la materia y cuáles son sus propiedades
Tanto el aire como el agua, así como las piedras e incluso nosotros mismos los seres humanos son ejemplos de materia y todos son diferentes.
Los diferentes tipos de materia pueden ser descritos por su masa. Ahora bien, la masa es la cantidad de materia de la que está compuesto un objeto. Por ejemplo, un balón de fútbol tiene menos masa que una bola de boliche.
La masa es una de las propiedades de la materia, que veremos más adelante.
Cómo está compuesta la materia
La materia se compone de moléculas que no podemos ver a simple vista, y que son la unidad más pequeña en la que se puede dividir la materia sin que pierda sus propiedades o su naturaleza.
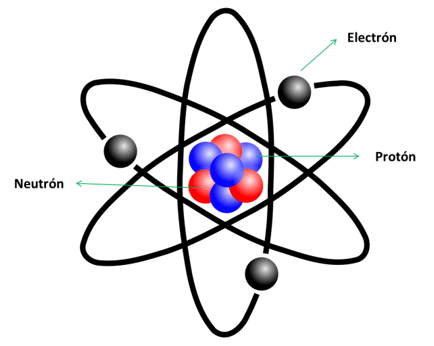
Las moléculas a su vez están compuestas por átomos que tienen diferentes propiedades, dependiendo de la molécula de la materia a la que pertenecen.
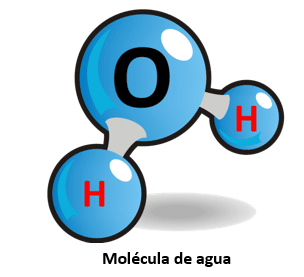
Pongamos como ejemplo la molécula de agua. La molécula de agua puede escribirse como H2O, porque está constituida por 2 átomos de hidrógeno (H) y un átomo de oxígeno (O).
Los átomos a su vez están compuestos por protones, electrones y neutrones.
Las propiedades de la materia
La materia tiene propiedades que pueden definirse como las características específicas que pueden ayudarnos a distinguir un cuerpo de otro, o un tipo de materia de otro.
En este artículo nos enfocaremos en las propiedades físicas para poder entender los estados de la materia.
Propiedades físicas de la materia
A su vez las propiedades físicas de la materia pueden ser de dos tipos:
- Propiedades extensivas, dependen de la cantidad de materia que se mida
- Propiedades intensivas, también llamadas propiedades intrínsecas, no dependen de la cantidad de materia presente.
Algunas propiedades físicas de la materia son las siguientes:
Masa:
- La masa es la cantidad de materia que tiene un cuerpo u objeto. La masa es una propiedad extensiva.

- La cantidad de materia que tiene un cubo de hielo que usamos para enfriar una bebida es distinta a la cantidad de materia del iceberg que golpeó al Titanic.
Peso:
- El peso es la gravedad o fuerza de atracción hacia su centro que ejerce la Tierra sobre la materia. El peso es una propiedad extensiva.

- Por ejemplo, una persona con una masa de 60 Kg pesará 588,6 N en la superficie de la Tierra y 98,05 N en la superficie de la luna.
Volumen:
- Se refiere al espacio que ocupa un cuerpo u objeto (extensiva).
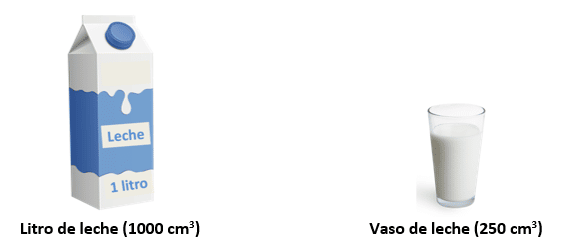
- En nuestro sistema métrico decimal el volumen es medido en cm3. Por ejemplo, un litro de leche es equivalente a 1000 cm3 de leche, y un vaso de leche equivale a 250 cm3 de leche, aproximadamente.
Densidad:
- Esta propiedad consiste en la relación del peso con el volumen de los objetos. Esta es una propiedad intensiva de la materia. Por ejemplo si comparamos una roca con un trozo de corcho del mismo tamaño pueden tener igual volumen pero sabemos que la roca será más pesada. Esto quiere decir que la roca es más densa que el corcho porque tiene más masa por cada unidad de volumen.
Color:
- Es el aspecto que tiene la materia ante el ojo humano. El color es una propiedad intensiva.

- El color de un lingote de oro es el mismo que de un anillo de oro. Es decir que esta propiedad no depende de la cantidad de materia del objeto.

- El color de la madera es diferente al color del algodón.
Punto de ebullición:
- Este se refiere al punto máximo de temperatura que alcanza una sustancia en estado líquido antes de convertirse en gas.

- En el caso del agua, que es el líquido más común para nosotros, su punto de ebullición es 100°C.
- Mientras que el aceite de oliva virgen tiene un punto de ebullición de 216 °C.
Punto de fusión:
- Este punto es la temperatura en la cual un cuerpo sustancia pasa de estado sólido a líquido.
- Algunos ejemplos de fusión son derretir hielo, fundir metales como el oro o el hierro para darles nuevas formas, derretir velas, derretir el queso o derretir chocolate.
Elasticidad:
- Es la propiedad que tienen algunos cuerpos de volver a su forma original después de haberse deformado por la aplicación de una fuerza externa. La elasticidad es una propiedad intensiva.

- Por ejemplo, las gomas o bandas elásticas vuelven a su forma original después de haberlas estirado con la mano.
Materia y materiales
Gracias a nuestros sentidos podemos examinar los cuerpos que se encuentran en nuestro entorno. El olfato, por ejemplo, nos ayuda a percibir el olor que se desprende de la tierra húmeda, nuestras manos nos permiten apreciar la textura de los objetos y el gusto nos invita constantemente a deleitarnos con los ricos sabores de las frutas u otros platillos que nos fascinan.
Todos estos elementos que observan nuestros sentidos son cuerpos conformados por materiales, en los que la materia es el componente principal en todos los casos.

Los seres humanos necesitamos consumir una gran variedad de productos. Hagámoslo de manera responsable para así evitar generar una gran cantidad de residuos ambientales.
¿Qué es la materia?
Está formada por pequeñísimas partículas llamadas átomos. Y está presente en todo lo que está a nuestro alrededor incluyéndonos a nosotros mismos.
¿Qué es un cuerpo?
Un árbol y una silla son cuerpos diferentes porque en el primero la materia está viva y en el segundo no.
¿Qué son los materiales?
El hierro, la madera, el agua, el caucho y el vidrio son ejemplos de materiales. Para clasificarlos se pueden utilizar distintos criterios, algunos de ellos son su estado de agregación, su forma de obtención y su origen (artificiales o naturales).

Un ordenador está hecho de una gran cantidad de materiales: metales, plásticos y vidrio. Para la construcción de un automóvil se utiliza acero, plástico, aluminio, hule y vidrio.
Diferencia entre materia y materiales
Por ejemplo, una silla puede ser de madera, hierro o plástico, la diferencia entre estos tres cuerpos es el tipo de material utilizado para su construcción.

El oro es el material mejor valorado en la joyería debido a su maleabilidad.
Tipos de materia y características
La materia se clasifica en sustancias puras y mezclas.
Sustancias puras
- Tienen propiedades específicas que las caracterizan y no pueden separarse en otras sustancias por procedimientos físicos. Estas sustancias se clasifican en elementos y compuestos.
- Elementos:
- También denominadas sustancias puras simples están constituidas por una sola clase de átomos, es decir, átomos con igual número de protones en su núcleo, por lo que tienen las mismas propiedades químicas. No es posible descomponer los elementos en otras sustancias puras más sencillas por ningún procedimiento. Todos los elementos químicos de la tabla periódica son sustancias puras simples.
- Elementos:
- Tienen propiedades específicas que las caracterizan y no pueden separarse en otras sustancias por procedimientos físicos. Estas sustancias se clasifican en elementos y compuestos.

- Compuesto:
- Dos o más elementos de la tabla periódica en proporciones fijas forman un Compuesto. Se caracterizan por poseer una fórmula química que expresa los distintos elementos que forman al compuesto y su cantidad. Los compuestos pueden ser separados en sustancias más simples mediante reacciones químicas, nunca a través de métodos químicos.
- Por ejemplo, la formación de óxido de hierro es producido al reaccionar el aire con el hierro de forma natural.
- Compuesto:

Mezcla
- Por ejemplo si se mezcla bicarbonato de sodio con agua, cada sustancia conserva sus propiedades. Una característica de las sustancias que conforman una mezcla es que pueden presentarse en mayor o menor cantidad, otra es que pueden separarse mediante métodos físicos.
- En la mezcla de bicarbonato de sodio y agua puede utilizarse la evaporación para separar los elementos de esta mezcla.

Mezcla homogénea
- Las mezclas homogéneas también se conocen con el nombre de disoluciones. Una característica de estas mezclas es que son completamente uniformes por lo que sus componentes no pueden verse a simple vista. La composición y las propiedades de este tipo de mezclas son uniformes. El café con leche, el vino y la harina con azúcar son ejemplos de mezclas homogéneas.

Mezcla heterogénea
- Las mezclas heterogéneas poseen una composición que no es uniforme, sus componentes son observables, es decir, se distinguen a simple vista las diferentes sustancias en la mezcla. Una mezcla heterogénea no es uniforme, por ejemplo si observas el agua y el azúcar, el agua y el aceite o las piedras y la madera, puedes ver como cada sustancia ocupa una zona de la mezcla.
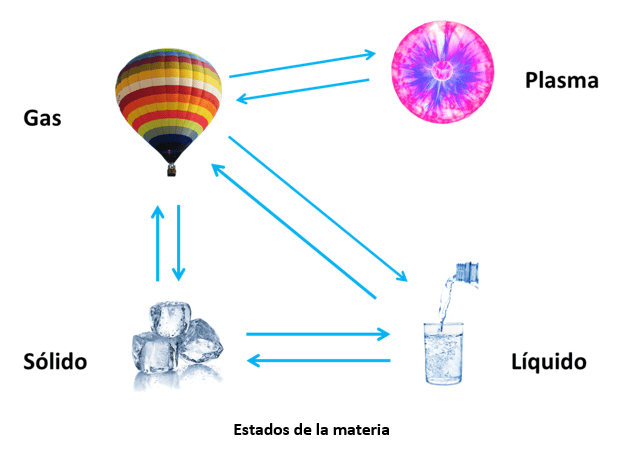
Qué son los estados de la materia
Como vimos anteriormente, la materia está formada por átomos que están compuestos por electrones, neutrones y protones. Estos átomos se unen para formar moléculas, como la molécula de agua.
Ahora bien, la energía de movimiento que hay entre los átomos y las moléculas de la materia determina el estado en que se encuentra la materia.
Cuáles son los estados fundamentales de la materia
La principal diferencia entre el material en estado sólido, estado líquido y estado gaseoso es qué tan rápido se mueven sus moléculas. Estudiaremos cada uno a continuación.
Estado sólido
La materia en estado sólido tiene como característica principal que tienen una forma definida, por lo que se resiste al cambio de forma, es decir que no se ajusta al recipiente donde lo coloquen.
Además los sólidos tienen una alta densidad porque en los sólidos las moléculas están muy juntas. Esto significa que las moléculas de los sólidos no pueden moverse mucho pues tienen energía cinética muy baja.
En los sólidos los electrones de cada átomo se encuentran en movimiento constante por lo que tienen una pequeña vibración pero están fijos en su posición.
Ejemplos de materia en estado sólido
Algunos ejemplos de sólidos que podemos encontrar en nuestro planeta son cristales, sales, diamantes, piedras, hielo, y madera.

Características de los sólidos
- Tienen forma y volumen constante.
- No se pueden comprimir solo con apretarlos.
- Aumentan su volumen al calentarse (dilatación).
- Disminuyen su volumen al enfriarse (contracción).
- Pueden tener características de dureza o de fragilidad.
- Pueden cambiar de estado a líquido o a gaseoso debido a cambios de presión y de temperatura.
Estado líquido
La materia en estado líquido se caracteriza por tener volumen y una forma indefinida, pues sus moléculas fluyen una alrededor de otras al estar mucho más sueltas que en los sólidos.
El ejemplo más cotidiano que tenemos de la materia en estado líquido es el agua.
En los líquidos existe cierto equilibrio entre las fuerzas de atracción y repulsión de sus partículas por lo que están más alejadas que en los sólidos pero más próximas que en los gases.
Ejemplos de materia en estado líquido
Algunos ejemplos de materia en estado líquido son la leche, el jugo de naranja, la sopa, la lluvia, el aceite de oliva, la miel, el agua y el queroseno.

Características de los líquidos
- Los líquidos toman la forma del envase que los contiene, es decir que no tienen forma definida pero sí tienen volumen.
- Los líquidos tienen tensión superficial que se da por las fuerzas de atracción en todas las direcciones que tienen sus partículas.
- La viscosidad es otra característica de los líquidos. La viscosidad en los líquidos es la velocidad con la que éste se desparrama o fluye.
- Los líquidos tienen la propiedad de la capilaridad que ocurre cuando las moléculas del líquido suben por tubos capilares (de pequeño diámetro), pues es más fuerte la interacción con las moléculas del tubo (adhesión) que entre ellas (cohesión).
- La capilaridad del agua es muy importante para que se mantenga la vida en nuestro planeta porque gracias a esta propiedad de los líquidos el agua de lluvia se “escurre” bajo la tierra a través de tubos capilares naturales.
- Los líquidos tienen punto de ebullición, que es la temperatura máxima a la que hierven y pasan al estado gaseoso.
Estado gaseoso
La teoría cinética de los gases comienza a desarrollarse gracias a los aportes de Daniel Bernoulli en el siglo XVII y termina de completarse a mediados del siglo XX con los trabajos de James Clerk Maxwell. Con el objetivo de explicar el comportamiento y las propiedades de los gases esta teoría parte de las siguientes hipótesis:
- Un gas está formado por pequeñísimas partículas, que se encuentran bastante separadas entre sí. Entre cada una solo hay espacio vacío.
- En continuo movimiento se encuentran las partículas que forman el gas. El movimiento predominante es el de traslación, aunque también vibran y rotan. Al moverse las partículas se golpean unas con otras y con las paredes del recipiente que las contiene.
- Al proporcionársele energía a un gas, el movimiento de las partículas se incrementa. Esto trae como consecuencia que su temperatura aumente.
- El número de partículas y los choques de ellas contra las paredes del recipiente que las contiene es proporcional a la presión que ejerce el gas.
Los gases no poseen volumen ni forma propia, las partículas que los forman están en constante movimiento y llenan el volumen del recipiente que las contiene. Las moléculas de un pueden fluir hacia el espacio.
Es posible reducir el volumen de un gas (los gases pueden comprimirse) esto debido a que sus partículas están bastante separadas entre sí. Este proceso se realiza ejerciendo presión sobre las partículas que forman el gas lo que disminuirá el espacio entre ellas. De esta manera se disminuye el espacio disponible en el que desplazan las partículas. En consecuencia, el volumen disminuye pero la cantidad de gas no se ve alterada, puesto que el número de partículas contenidas en el recipiente no varía.
Características del estado gaseoso
- La interacción entre las partículas es poca porque se encuentran bastante separadas entre sí.
- Los líquidos y los sólidos poseen más partículas que los gases.
- Las partículas se mueven de manera constante y de forma desordenada.
- Los gases no poseen forma ni volumen.
- En su mayoría los gases no se pueden tocar, no tienen color ni sabor.
- Los gases se hacen más flexibles al ser comprimidos lo que permite que se adapten al recipiente que los va a contener.
- Los gases pueden ocupar todo el volumen del que disponen.
Algunos de los gases que podemos encontrar en nuestro planeta son:

Estado plasmático
El plasma también conocido como el cuarto estado de la materia se encuentra en la atmósfera terrestre, específicamente en la magnetosfera y la ionosfera. Además, es posible encontrarlo en los vientos polares y en las auroras boreales.
El término plasma fue utilizado por primera vez por el físico estadounidense Irving Langmuir en el año 1928. Este científico utilizó este término para definir ese gas ionizado de una alta conductividad eléctrica que se encuentra en grandes cantidades en el medio intergaláctico, interplanetario e interestelar, así como en los vientos solares y las estrellas.
Se denomina plasma a un gas formado por átomos a los que les han retirado o sumado electrones, por lo que tienen una carga eléctrica fija (aniones (-) y cationes (+)). Estas propiedades hacen que el plasma sea un excelente conductor de energía eléctrica.
Características del plasma
- Las partículas plasmáticas interactúan con gran intensidad con los campos electromagnéticos.
- El plasma no es frecuente en la cotidianidad, se encuentra principalmente en las estrellas, el sol, el fuego, los relámpagos y medio intergaláctico, interplanetario e interestelar.
- Es posible obtener materia plasmática mediante la ionización de los gases, este proceso se puede lograr a través del calentamiento del gas para que sus partículas vibren más velozmente. También se puede obtener por magnetización o por aplicación de electricidad, así como por medio de otros procesos artificiales.
- Es un magnífico conductor de electricidad.
Ejemplos de plasma
Cambios de estados de la materia
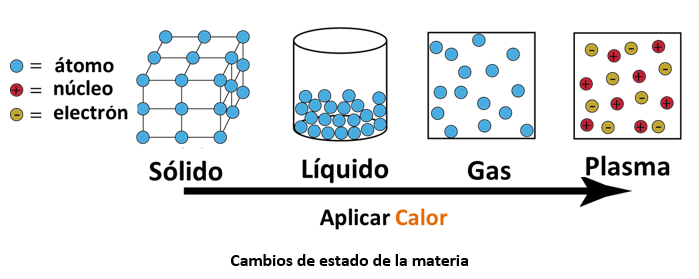
Los cambios de estado podemos observarlos frecuentemente en nuestra vida. Por ejemplo cuando sacamos el hielo del congelador (agua en estado sólido) y empieza a derretirse convirtiéndose en agua en estado líquido.
Igualmente cuando calentamos agua en estado líquido, esta empieza a hervir y a evaporarse (convertirse en gas).
Otro ejemplo podemos verlo cuando nos preparamos una taza de chocolate caliente. Muchas veces vemos como parte del líquido pasa a convertirse en gas y vemos el “humo” que sale de la taza.

Taza de chocolate caliente con materia cambiando de estado líquido a gaseoso
Por qué ocurren los cambios de estado de la materia
Los cambios de estado de la materia, de acuerdo con el modelo de partículas, ocurren cuando cambia la temperatura de un cuerpo suficientemente como para alterar la energía cinética de sus partículas, es decir la movilidad o interacción entre ellas.
Por ejemplo, cuando se aplica suficiente energía térmica (calor) a un sólido, la energía cinética de sus partículas aumenta (tienen más movilidad) y la fuerza de atracción disminuye (hay más espacio entre ellas), por lo que se mueven más libremente y el sólido puede pasar a estado líquido.
Ahora si queremos que el líquido pase al estado sólido o un gas pase a estado líquido se le quita al sistema la energía térmica suficiente para disminuir la energía cinética de sus partículas y estas empezarán a atraerse entre ellas.
Clasificación de los cambios de estado de la materia
Los cambios de la materia pueden clasificarse de acuerdo a la pérdida o ganancia de temperatura que ha ocurrido para que el cambio suceda. Recordemos que los cuerpos pueden ganar o perder temperatura y de acuerdo a lo que suceda cuando cambien de estado se clasifican en:
- Cambios progresivos: Estos cambios suceden cuando la materia absorbe energía térmica para cambiar de estado.
- Cambios regresivos: Este tipo de cambio ocurren cuando el material cede energía para que se dé el cambio de estado.

Cambios progresivos y regresivos de la materia
Cambios progresivos de la materia
Los cambios progresivos de la materia se denominan fusión, vaporización y volatilización. Recordemos que estos cambios se producen cuando la materia absorbe energía calórica. Veamos de qué tratan:
- Fusión: Este es el cambio de estado sólido a líquido. Un ejemplo de este estado es calentar mantequilla en el sartén y esta se derrite.

- Vaporización: es el paso del estado líquido al estado gaseoso. La vaporización puede ocurrir por ebullición o evaporación.
- La evaporación ocurre cuando solamente las partículas superficiales del líquido se convierten en gas.
- Por ejemplo lo que ocurre con una taza de té caliente cuando sale “humo” y es realmente las partículas superficiales del líquido que están convirtiéndose en gas.

- La ebullición ocurre cuando el líquido alcanza la temperatura de ebullición y el cambio de estado se produce en todas las partículas del líquido. Un ejemplo de ello es cuando hervimos agua.

- Sublimación: este el paso de estado sólido al estado gaseoso. Un ejemplo de sublimación es el caso de la naftalina sólida que volatiliza y pasa a ser un gas.
Cambios regresivos de la materia
Los cambios regresivos de la materia ocurren cuando ésta cede calor. Estos cambios son:
- Solidificación: es el cambio de la materia de estado líquido a estado sólido. Por ejemplo cuando ponemos agua en el congelador ésta cede energía calórica al aire frío, y pasa a solidificarse en forma de hielo.

- Condensación: es el paso de estado gaseoso a estado líquido. Este proceso es el que ocurre cuando el agua en estado gaseoso se enfría y se vuelve líquida. Por ejemplo, cuando los vasos con bebidas frías “sudan” porque las moléculas de agua en el aire que rodea el vaso pierden energía calórica al chocar con la superficie fría del vaso, pasando del estado gaseoso al líquido.

- Deposición o sublimación regresiva: este es el cambio de estado de gas a sólido. Un ejemplo de ello es la nieve que se produce en zonas en las que la temperatura es tan baja que no le da tiempo al vapor de agua de convertirse en lluvia, y se convierte directamente en hielo.

Experimentos sencillos para cambios de estado de la materia
Los experimentos son un gran apoyo cuando se pretende que los niños comprendan los principios científicos. Por esa razón presentamos a continuación una serie de experimentos que motivarán y despertarán la curiosidad de los niños con relación a los cambios de estado de la materia.
Experimento de solidificación de la materia (paso de estado líquido a sólido).
La solidificación del jugo de naranja
Materiales:
- Dos vasos de plásticos iguales.
- 100 ml de Jugo de naranja
- Un vaso graduado.
- Nevera o frigorífico.
Procedimiento y conclusiones:
- Con ayuda del vaso graduado, colocamos 50 ml de jugo de naranja en cada vaso plástico, para que las dos tengan la misma cantidad de jugo. Seguidamente, metemos uno de los vasos con jugo en el congelador y el otro en el refrigerador o nevera.
- Dejamos que transcurran unas 3 horas.
- Una vez transcurridas las 3 horas, retiramos los vasos del congelador y la nevera y los colocamos en una mesa. Al observar ambos vasos nos daremos cuenta que el jugo de naranja del congelador se ha convertido en hielo (pasa de estado líquido a sólido), mientras que el de la nevera sólo está muy frío (continúa en estado líquido).
Experimento de fusión (paso de estado sólido a líquido)
La fusión de una barra de chocolate
Materiales:
- Una barra de chocolate
- Agua
- Una cacerola
- Un bol de vidrio o plástico más pequeño que la cacerola
- Una estufa
- Espátula de madera.
- Galletas dulces para untar.
Procedimiento y conclusiones:
- Con la ayuda de papá o mamá coloca la cacerola en la estufa y vierte agua en ella. Calienta el agua hasta que hierva. Luego reduce el fuego a medio bajo hasta que el agua alcance un hervor lento constante.
- Seguidamente coloca la barra de chocolate picada en trozos en el bol e introdúcelo en la cacerola que está sobre la estufa. Con la espátula remueve el chocolate hasta que se funda.
- Una vez fundido retira la cacerola y el bol del fuego. Unta un poco del chocolate fundido a tus galletas y disfruta de un rico refrigerio.
- Con este experimento hemos observado cómo si le aplicamos calor a la barra de chocolate, ésta cambia de estado, de sólido a líquido.

Experimento de vaporización (paso de estado líquido a gaseoso)
La vaporización del agua
Materiales:
- 50 ml de agua.
- Una olla.
- Una estufa
Procedimiento y conclusiones:
- Colocamos agua en la olla al fuego y dejamos que hierva.
- Observamos cómo el vapor de agua comienza a elevarse y el agua a burbujear. Si dejamos el agua al fuego durante aproximadamente 10 minutos veremos cómo se evapora completamente.
- En conclusión el agua cambia de estado, del líquido al gaseoso, cuando su temperatura se incrementa hasta los 100 ºC.

Experimento de condensación (paso de estado gaseoso a líquido)
La condensación del agua
Materiales:
- Un recipiente resistente al calor.
- Una estufa
- Una liga
- Agua
- Un abanico
Procedimiento y conclusiones:
- Se coloca un poco de agua en el recipiente.
- Luego se coloca una bolsa transparente y se ajusta con una liga sobre el cuello del recipiente.
- Se hierve el agua hasta que se evapore toda y observamos cómo el vapor de agua infla la bolsa.
- Con un abanico echa aire para que se enfríe el agua en forma de gas que está dentro de la bolsa.
- El gas que estaba dentro de la bolsa cambia al estado líquido. Si observa con atención se podrá ver cómo las gotitas de agua se van acumulando dentro la bolsa plástica.
Con este experimento se puede ver como si se enfría el gas que se produce de hervir el agua, podemos visualizar la manera de cambiar del estado gaseoso al líquido.

Nuevos estados de la materia
La ciencia y los científicos en condiciones de laboratorio han logrado descubrir nuevos estados de la materia, no son tan sencillos de visualizar como es el caso de los estados sólido, líquido, gaseoso y plasma, pero han sido planteados por los investigadores en algunos de sus trabajos. Veamos a continuación algunos de ellos:
Consensado de Bose-Einstein
Durante la segunda década del siglo XX los científicos Satyendra Bose y Albert Einstein conjeturaron la existencia de un nuevo estado de la materia al trabajar con la mecánica cuántica y la estadística. Un tiempo más tarde, a finales de este mismo siglo, los físicos Eric A. Cornell, Wolfgang Ketterle y Carl E. Wieman lograron enfriar átomos a una temperatura unas 300 veces más baja de lo que se había logrado para ese momento.
En este estado de la materia los átomos se encuentran completamente quietos. Las partículas que la constituyen caen todas al mismo nivel de energía haciéndose indistinguibles unas de otras, pasando a formar un superátomo.
Súper cristal
Un súper cristal se forma de la interacción de partículas cuánticas a altas densidades y bajas temperaturas. Se caracteriza por su súper fluidez y por poseer una estructura amorfa solidificada.
Súper sólido
Un súper sólido es creado bajo condiciones de laboratorio llevando átomos de helio-(4) a temperaturas extremadamente bajas. La organización de los átomos en este estado de materia es similar a la de un sólido normal, como es el hielo, sólo que en este caso aunque estarían congelados, las partículas que conforman la materia no se encuentran completamente quietas.
Súper fluido
El súper fluido es un estado de la materia en el que la sustancia no presenta ningún tipo de viscosidad.

Por último, te dejamos unos juegos para practicar lo aprendido en este artículo:
Selecciona un juego 👇 👇 👇

Propiedades de la materia

Materia - material y cuerpo

Clasificación de la materia

Estados de la materia

Cambios de estado

Nuevos estados de la materia

Propiedades de la materia

Materia - material y cuerpo

Clasificación de la materia

Estados de la materia

Cambios de estado

Nuevos estados de la materia
![]() Registrado en SafeCreative.
Registrado en SafeCreative.
También te pueden interesar estos temas de Ciencias Naturales
Recursos de ciencias naturales
- FÍSICA Y QUÍMICA
- 1.- El mol
- 2.- Estados de la materia
- 3.- Estructura atómica
- 4.- Ley de Newton
- 5.- Máquinas simples y máquinas compuestas
- 6.- Metodología científica
- 7.- Tabla periódica de los elementos