El mol
Alguna vez te has preguntado cómo hacen los científicos para trabajar con cosas tan pequeñas como átomos y moléculas, o cómo se las arreglan para contar estas partículas al momento de hacer alguna mezcla química. Pues para resolver esto, ellos usan el mol que, en realidad, es más parecido al uso que comúnmente le damos a la docena de lo que puedas imaginar.
En este artículo te enseñamos de manera sencilla qué es el mol, para qué sirve, qué es la masa molar y mol de moléculas. Lee hasta el final para que aprendas todo lo que necesitas saber sobre este tema fundamental en química.
Qué es el mol
Antes de definirlo formalmente, debemos decirte que el mol es una unidad de medida que se usa para saber cuántos átomos o cuántas moléculas hay en una determinada cantidad de masa.
Estas unidades elementales pueden ser átomos, moléculas, electrones, iones, etc.
Para ayudarte a entender mejor esto del mol vamos a referirnos a algo que sí conoces, la docena. Como sabes:
- 1 docena de peras = 12 peras
- 1 docena de melones = 12 melones
- 3 docenas de peras = 4 · (12 peras)
Lo mismo ocurre con el mol. Observa:
- 1 mol de átomos = 6,02 · 1023 átomos
- 1 mol de moléculas = 6,02 · 1023 moléculas
- 1 mol de Na = 6,02 · 1023 átomos de Na
Ahora sí vamos a definir el mol:
El mol se define así porque se toma como referencia la cantidad de sustancia que contiene tantas unidades elementales como átomos hay en exactamente 0,012 kilogramos de carbono-12 . ¡De ahí salió ese número!
Esta cantidad se conoce también como número de Avogadro. Y es una cantidad muy grande, mira:
- 6,022045 · 1023 partículas = 602,204,500,000,000,000,000,000 partículas
Es tan grande porque las partículas elementales son realmente pequeñas, y para poder tener una cantidad suficiente que se pueda medir en gramos es necesario tener muchas de ellas.
Observa cuántos gramos hay en un mol de algunos elementos y compuestos que conoces. Aquí te presentamos el peso en gramos del átomo de sodio y del átomo de cloro:
| Átomo de Sodio (Na) | Átomo de Cloro (Cl) |
| 3,8175458 × 10-23 g | 5,8871086 × 10-23 g |
Si tomamos 1 mol de átomos de Na y 1 mol de átomos de Cl tendremos que la masa de 1 mol de átomos de Na es menor que la masa de 1 mol de Cl.
En la siguiente tabla puedes comparar ambas masas:
| 1 Mol de átomos de Sodio (Na) | 1 Mol de átomos de Cloro (Cl) |
| 23 gramos | 35,45 gramos |
La masa de 1 mol de un elemento o compuesto va a depender de la masa atómica del elemento o compuesto al que nos estemos refiriendo. Eso lo explicamos más detalladamente en otros apartados de este artículo.
Para qué sirve el mol
El mol es usado por los científicos para llevar la cuenta de las moléculas, átomos (o cualquier otra entidad elemental) que necesiten medir al configurar las reacciones químicas o sustancias que buscan cuando trabajan en el laboratorio.
Recordemos que es muy complicado contar átomos o moléculas, por ejemplo, pues son partículas muy pequeñas, entonces los científicos miden los moles que necesitan de cada uno de los componentes de la mezcla que desean hacer, para que éstos se combinen creando la sustancia o reacción química que buscan.
Por ejemplo, digamos que en un laboratorio se desea crear NaCl o cloruro de sodio (sal de mesa).
La molécula de sal de cloruro de sodio es esta:
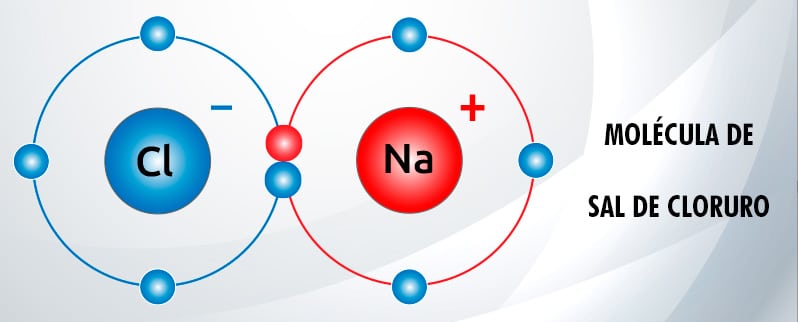
Imagina que estás en una situación en la que tienes Cloro y Sodio y quieres formar NaCl (sal de mesa). Para formar una molécula de NaCl necesitas un átomo de cloro por cada átomo de sodio. Entonces usamos el mol como medida.
Si tomamos 1 mol de sodio y 1 mol de cloro tendríamos 6,02 x 1023 átomos de cada elemento.
Para poder obtener 1 mol de moléculas de NaCl mediríamos 23 gramos de Sodio (Na) y 35,45 gramos de Cloro (Cl). Pues esa es la masa de 1 mol de cada uno de estos elementos, tal como vimos antes.
Podemos decir que el mol es un puente entre las cosas de tamaño normal, que experimentamos todos los días, en el universo de lo muy pequeño.
Qué es la masa molar
Las unidades de masa molar son gramos por mol, abreviado como g/mol. Un mol es equivalente a 6.022 x 10 elevado a 23 partículas.
La masa molar es llamada también masa atómica. El valor numérico de la masa molar es igual al de la masa molecular, la primera se expresa en gramos/mol y la segunda se simboliza con las unidades de masa atómica (u). La diferencia más importante entre estos dos conceptos es que la masa molecular hace referencia a una sola molécula y la masa molar alude a un mol (6,022×1023) de moléculas.
Por ejemplo, el hierro tiene un peso atómico de 55,845 , esto significa que hay 55,845 gramos en un mol de hierro. Mientras que si nos referimos al plomo tenemos que su masa atómica es 207,2 por lo que en un mol hay 207,2 gramos de plomo.
En la tabla periódica podemos ubicar la masa molar (masa atómica) de los elementos. Veamos:

Al observar la tabla periódica podemos notar que en la parte superior del elemento se encuentra su masa atómica o masa molar. Es así como la masa molar del Cromo es de 51,9961 g/mol y la del Argón es 39,948 g/mol.
A continuación, te presentamos una tabla con los 108 elementos de la tabla periódica, ordenados de menos a mayor a partir de su masa molar
| Elemento | Masa molar (g/mol) | Elemento | Masa molar (g/mol) | Elemento | Masa molar (g/mol) | Elemento | Masa molar (g/mol) | Elemento | Masa molar (g/mol) |
| Hidrógeno (H) | 1,0079 | Cromo (Cr) | 51,9961 | Plata (Ag) | 107,8682 | Iterbio (Yb) | 173,04 | Uranio (U) | 238,0289 |
| Helio (He) | 4,0026 | Manganeso (Mn) | 54,938 | Cadmio (Cd) | 112,411 | Lutecio (Lu) | 174,967 | Americio (Am) | 243 |
| Litio (Li) | 6,941 | Hierro (Fe) | 55,845 | Indio (In) | 114,818 | Hafnio (Hf) | 178,49 | Plutonio (Pu) | 244 |
| Berilio (Be) | 9,0122 | Níquel (Ni) | 58,6934 | Estaño (Sn) | 118,71 | Tantalio (Ta) | 180,9479 | Curio (Cm) | 247 |
| Boro (B) | 10,811 | Cobalto (Co) | 58,9332 | Antimonio (Sb) | 121,76 | Wolframio (W) | 183,84 | Berkelio (Bk) | 247 |
| Carbono (C) | 12,0107 | Cobre (Cu) | 63,546 | Iodo (I) | 126,9045 | Renio (Re) | 186,207 | Californio (Cf) | 251 |
| Nitrógeno (N) | 14,0067 | Zinc (Zn) | 65,39 | Teluro (Te) | 127,6 | Osmio (Os) | 190,23 | Einstenio (Es) | 252 |
| Oxígeno (O) | 15,9994 | Galio (Ga) | 69,723 | Xenón (Xe) | 131,293 | Iridio (Ir) | 192.217 | Fermio (Fm) | 257 |
| Flúor (F) | 18,9984 | Germanio (Ge) | 72,64 | Cesio (Cs) | 132,9055 | Platino (Pt) | 195,078 | Mendelevio (Md) | 258 |
| Neón (Ne) | 20,1797 | Arsénico (As) | 74,9216 | Bario (Ba) | 137,327 | Oro (Au) | 196,9665 | Nobelio (No) | 259 |
| Sodio (Na) | 22,9897 | Selenio (Se) | 78,96 | Lantano (La) | 138,9055 | Mercurio (Hg) | 200,59 | Rutherfordio (Rf) | 261 |
| Magnesio (Mg) | 24,305 | Bromo (Br) | 79,904 | Cerio (Ce) | 140,116 | Talio (Tl) | 204,3833 | Lawrencio (Lr) | 262 |
| Aluminio (Al) | 26,9815 | Kriptón (Kr) | 83,8 | Praseodimio (Pr) | 140,9077 | Plomo (Pb) | 207,2 | Dubnio (Db) | 262 |
| Sílice (Si) | 28,0855 | Rubidio (Rb) | 85,4678 | Neodimio (Nd) | 144,24 | Bismuto (Bi) | 208.9804 | Bohrio (Bh) | 264 |
| Fósforo (P) | 30,9738 | Estroncio (Sr) | 87,62 | Promecio (Pm) | 145 | Polonio (Po) | 209 | Seaborgio (Sg) | 266 |
| Azufre (S) | 32,065 | Itrio (Y) | 88,9059 | Samario (Sm) | 150,36 | Ástato (At) | 210 | Meitnerio (Mt) | 268 |
| Cloro (Cl) | 35,453 | Zirconio (Zr) | 91,224 | Europio (Eu) | 151,964 | Radón (Rn) | 222 | Hassio (Hs) | 277 |
| Potasio (K) | 39,0983 | Niobio (Nb) | 92,9064 | Gadolinio (Gd) | 157,25 | Francio (Fr) | 223 | ||
| Argón (Ar) | 39,948 | Molibdeno (Mo) | 95,94 | Terbio (Tb) | 158,9253 | Radio (Ra) | 226 | ||
| Calcio (Ca) | 40,078 | Tecnecio (Tc) | 98 | Disprosio (Dy) | 162,5 | Actinio (Ac) | 227 | ||
| Escandio (Sc) | 44,9559 | Rutenio (Ru) | 101,07 | Holmio (Ho) | 164,9303 | Protactinio (Pa) | 231,0359 | ||
| Titanio (Ti) | 47,867 | Rodio (Rh) | 102,9055 | Erbio (Er) | 167,259 | Torio (Th) | 232,0381 | ||
| Vanadio (V) | 50,9415 | Paladio (Pd) | 106,42 | Tulio (Tm) | 168,9342 | Neptunio (Np) | 237 |
Mol de moléculas
La masa de una motocicleta es la suma de las masas de sus partes, de igual manera la masa de una molécula es la suma de las masas de los elementos que la forman. Así:

La suma de las masas de las partes de estas tres motocicletas es igual a la masa total de los tres vehículos
Si nos interesa calcular la masa molar molecular de algún compuesto, necesitamos saber qué elementos conforman dicho compuesto, cuántos son y cuál es la masa de cada uno. A partir de la fórmula química del compuesto podemos obtener esta información.
Por ejemplo, para calcular la masa molar del peróxido de hidrógeno (agua oxigenada), requerimos la fórmula H2O2. En ella se indica que en un mol de este compuesto hay dos moles de hidrogeno y dos moles de oxígeno.
| Elementos | Masa molar (g/mol) | Moles de átomos | Total (g/mol) |
| Hidrógeno | 1,0079 | 2 | 1,0079 x 2 = 2,0158 |
| Oxígeno | 15,9994 | 2 | 15,9994 x 2 = 31,9988 |
| Masa molar del H2O2 | 34,0146 | ||
Si tenemos un mol de H2O2, entonces hay 6,02×1023 moléculas. El número de átomos de ese mol de moléculas es igual que 4×6,02×1023 = 24,08×1023, porque la fórmula del peróxido de hidrógeno señala que hay dos átomos de hidrógeno y dos de oxígeno en cada molécula, es decir, cuatro átomos en cada molécula.
Calculemos ahora la masa molar del Óxido de sodio cuya fórmula es Na2O. Veamos:
| Elementos | Masa molar (g/mol) | Moles de átomos | Total (g/mol) |
| Oxígeno | 15,9994 | 1 | 15,9994 x 1= 15,9994 |
| Sodio | 22,9897 | 2 | 22,9897 x 2 = 45,9794 |
| Masa molar del Na2O | 45,9794 | ||
En este caso tenemos un mol de Na2O, entonces hay 6,02×1023 moléculas. El número de átomos de ese mol de moléculas viene dado por 3×6,02×1023 = 18,06×1023, esto se debe a que la fórmula del óxido de sodio indica que hay dos átomos de sodio y uno de oxígeno en cada molécula, es decir, tres átomos en cada molécula.
Antes de concluir, te dejamos unos cuantos recursos más para que practiques lo aprendido.
Selecciona un juego 👇 👇 👇

Definición de mol

Masa molecular y mol de moléculas

Masa molar de los elementos químicos

Cálculo de la masa molar 1

Cálculo de la masa molar 2
También te pueden interesar estos temas de Ciencias Naturales

Definición de mol
Masa molecular y mol de moléculas

Masa molar de los elementos químicos

Cálculo de la masa molar 1

Cálculo de la masa molar 2
También te pueden interesar estos temas de Ciencias Naturales